الأدوية المثيلة، الأدوية الجنيسة أو الأدوية العامة. مع استمرار ارتفاع تكاليف الرعاية الصحية، تبدو الأدوية المثيلة أو المكافِئة جذابة لأي شخص لديه فاتورة أدوية كبيرة، لأنها قد توفر الكثير: فمثلاً دواء ليبتور Liptor وهو دواء للقلب والأوعية الدموية، له حماية براءة الاختراع، كان سعره 10 مليارات دولار – وظهرت علاجات بسعر أقل بكثير من التكلفة الأصلية. إذا كنت تتناول دواءً بوصفة طبية عن طريق الفم ولم تكن تتناول دواء أصيل بالفعل، فقد تفعل في المستقبل. واعتمادًا على مكان إقامتك ونوع خطة الأدوية التي لديك، فقد يتم تحويلك تلقائيًا إلى إصدار عام من دوائك الموصوف طبيًا بمجرد توفره.
إن الصيادلة مسؤولون عن أغلب التحولات من الأدوية ذات العلامة التجارية إلى الأدوية المثيلة. وتحدد اللوائح بشكل عام الأدوية والعلامات التجارية التي يمكن استبدالها تلقائيًا – أي بدون موافقة المريض أو الطبيب. ومن المفهوم أن يشعر العديد من المرضى بالقلق إزاء التحول إلى الأدوية العامة، وخاصة إذا كانوا يتحسنون على دواء ذي علامة تجارية وكانوا مستقرين لبعض الوقت. والمفاهيم الخاطئة شائعة، تتراوح من معايير التصنيع (“إنها أضعف!”) إلى الفعالية (“الأدوية لا تعمل!”).لذلك سنحاول تقديم ملخص قصير لعلم تقييم الأدوية الجنيسة (المثيلة)، وتحديداً مفهوم التكافؤ الحيوي ، والذي يؤكد لنا قابلية تبادل الأدوية المختلفة – أي أنه يمكن استبدال أحدها بآخر.
ما هو الدواء العام أو الدواء المثيل (generic drugs)؟
إن ما يُشار إليه بالدواء “العام” قد يختلف حسب البلد، ويتأثر بكل من الممارسة الطبية والمتطلبات التنظيمية. التعريف الشائع هو الذي تستخدمه منظمة الصحة العالمية:
الدواء المثيل أو العام هو منتج صيدلاني، يُقصد به عادةً أن يكون قابلاً للتبديل مع منتج مبتكر، ويتم تصنيعه بدون ترخيص من الشركة المبتكرة ويتم تسويقه بعد تاريخ انتهاء صلاحية براءة الاختراع أو الحقوق الحصرية الأخرى.
يمكن أيضًا تسمية المنتجات العامة بالمنتجات “متعددة المصادر”. وسترى في كثير من الأحيان أن الاسم الكيميائي للدواء يُشار إليه باسم “الاسم العام” أو الاسم “غير المملوك”، والذي وصفته يمكن أن تؤدي إلى ارتباك بين المستهلكين الذين قد يعرفون الوصفة الطبية الخاصة بهم فقط من خلال اسم العلامة التجارية وحده.
العنصر الصيدلاني الفعال
لفهم الأساس العلمي لتقييم الأدوية العامة، من الضروري فهم بعض المفاهيم الأساسية. الأول هو العنصر الصيدلاني النشط أو API. في ليبيتور، على سبيل المثال، API هو أتورفاستاتين، واسمه الكيميائي الكامل، (3R,5R)-7-[2-(4-fluorophenyl)-3-phenyl-4-(phenylcarbamoyl)-5-propan- 2-إيلبيرول-1-ييل]-3،5-ثنائي هيدروكسي هيبتانوات. API هي المادة الكيميائية التي لها التأثير البيولوجي المطلوب. قد يكون هناك عشرات المكونات في قرص الدواء ، ولكن المكون الصيدلاني النشط هو المكون الذي نهتم به وهو الذي يسمح لنا بتعميم البيانات والدراسات المتعلقة بالدواء، وربط العلوم المختبرية الأصلية والأبحاث قبل السريرية، إلى القرص الذي تصرفه الصيدلية، فهو نفس المادة الكيميائية.
حقيقة إن الأدوية تحتوي على مكونات فعالة تسمح بتسويق الأدوية الجنيسة، لأنه عندما نقارن الأدوية الجنيسة، فإن المكونات الفعالة هي نفسها. في المقابل، ضع في اعتبارك سيناريو العلاج بالأعشاب.
قد يحتوي قرص واحد يحتوي على 100 ملغ من العشب الخام على مئات من المواد الكيميائية المختلفة. إذا لم يكن هناك عنصر نشط معروف أو مكون نشط موحد، فلا يمكننا المقارنة بين العلامات التجارية، أو افتراض أن التجارب السريرية لعلامة تجارية واحدة ذات صلة بأي منتج آخر، لأنه ليس لدينا أي فكرة عن العنصر الذي له تأثير فعليًا، وإذا كان هناك أي إصدار آخر يحتوي على نفس المكون (أو مزيج من المكونات).
التوافر البيولوجي
تم تصميم معظم أشكال الجرعات (مثل الأقراص والكبسولات) لتوصيل العنصر النشط إلى موقع العمل في الجسم. ما لم يكن الدواء يعمل مباشرة على بطانة الجهاز الهضمي، فإننا نعتمد على الدورة الدموية لنقل الدواء إلى موقع العمل في الجسم. يشير التوافر البيولوجي إلى كمية الدواء التي تصل إلى مجرى الدم بمجرد تناولها. يتم تقييم التوافر الحيوي بناءً على مقياسين — معدل الامتصاص ومدى الامتصاص:
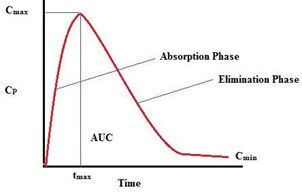
منحنى مستوى بلازما الدم لجرعة واحدة نموذجية من الدواء عن طريق الفم.
لنفترض أن جرعة من الدواء تؤخذ عن طريق الفم في وقت معين، يجب أن يتحلل القرص ثم يذوب المكون النشط. ومن ثم يجب أن يتم امتصاصه من خلال الجهاز الهضمي (مرحلة الامتصاص)، حيث ينتقل إلى الدم. يتم أخذ عينات دم بشكل تسلسلي (على سبيل المثال، كل 30 دقيقة) ويتم قياس تركيز الدواء. يتم بعد ذلك توصيل قياسات النقاط، مما ينتج عنه خط بياني.
في البداية، يتم امتصاص الدواء بسرعة، ويصل إلى ذروته عند تركيز معدل الامتصاص الأقصى في الرسم أعلاه ، في الوقت وقت الامتصاص الأقصى. يبدأ بعد ذلك التخلص من الدواء من الدم، حيث يمكن استقلابه، ربما عن طريق الكبد أو ترشيحه من الدورة الدموية عن طريق الكلى. يمكننا بعد ذلك حساب معدل الامتصاص، الموصوف بواسطة Cmax/tmax، والمدى الإجمالي للامتصاص، وهو المنطقة الواقعة تحت المنحنى (AUC)، محسوبة باستخدام حساب التفاضل والتكامل.
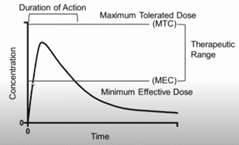
تتيح لنا دراسة التأثيرات الفسيولوجية للمركب النشط، وربطها بملف تعريف وقت التركيز، فهم ما إذا كان هناك حد أقصى للتركيز المسموح به (MTC) وما إذا كان هناك تركيز معين في الدم حيث يبدو أن عمل الدواء يبدأ ويتلاشى، وهو ما يسمى الحد الأدنى من التركيز الفعال (MEC). هذه القيم هي تقديرات، على أساس أن هناك علاقة بين تركيز الدواء في مجرى الدم، وكمية الدواء نفسه في موقع العمل في الجسم. ستوجه هذه التدابير كيفية تصنيع الدواء، في نهاية المطاف: نريد أن تتبع كل جرعة نفس المنحنى بشكل يمكن التنبؤ به وموثوق به. وهذا يعني طرق الإنتاج القياسية، واستخدام المواد التي تعمل جميعها على ضمان عدم وجود اختلاف يذكر من قرص إلى قرص أو من جرعة إلى جرعة. ويتم ذلك بهدف تقليل التباين بين المرضى أيضًا، وهو التباين الملحوظ بين المرضى المختلفين الذين يتلقون نفس شكل الجرعة.
قد تكون هناك طرق أخرى يمكن من خلالها تنويع الصياغة. عندما يكون الحد الأدنى من التركيز الفعال قريبة جدًا من الحد الأقصى المسموح به، قد يكون من الضروري زيادة الدقة لكل قرص. علاوة على ذلك، يمكننا تغيير شكل المنحنى، عن طريق القيام بأشياء مثل تغليف القرص معويًا، أو صنع نسخة ذات إطلاق مستمر تطلق المادة الفعالة بشكل أبطأ.
سيكون منحنى الامتصاص النهائي لأي مستحضر صيدلاني هو نتاج كل من الخصائص الفيزيائية للدواء (أي الخواص الكيميائية الجوهرية) وشكل الجرعة (أي الخواص الصيدلانية).
تواجه الشركات المصنعة العامة التي ترغب في تكرار دواء حاصل على براءة اختراع بعض التحديات. أولاً، تصنيع التركيب الكيميائي المعقد الذي يمثل المادة الفعالة. ثانيًا، تعبئته في شكل جرعة تشبه الدواء الحاصل على براءة اختراع. ثالثًا، إظهار أن الدواء الجنيس (المثيل) الجديد يشترك في نفس منحنى الامتصاص مثل الإصدار ذي العلامة التجارية. أي أنه يجب إثبات أن المنتجين متكافئان بيولوجياً.
التكافؤ الحيوي
نريد الآن مقارنة دواء يحمل علامة تجارية، وهو دواء موجود في السوق منذ سنوات، مع دواء عام جديد. هناك افتراض أساسي واحد يكمن وراء المقارنة:
يعتبر المنتجان متكافئين عندما لا يظهر معدل ‘‘ ومدى امتصاص الدواء العام اختلافًا كبيرًا عن معدل ومدى امتصاص الدواء ذو العلامة التجارية، عند تناولهما بنفس الجرعة في ظل ظروف تجريبية مماثلة.
لذلك لتوضيح هذا الأمر نحتاج إلى معرفة ما إذا كانت الأقراص متشابهة أم أنها تحتوي على مواد مختلفة. كما أننا لا نحتاج إلى إجراء تجارب سريرية على الدواء المثيل. إذا تمكنا من إثبات أن المادة الفعالة يتم امتصاصها بنفس معدل ومدى الدواء الذي يحمل العلامة التجارية، فيمكننا أن نعلن أن منتجين مكافئين حيويًا. وهذا يعني أن تناول أحدهما أو الآخر يؤدي إلى نفس النتيجة.
لنفترض أننا نريد مقارنة الدواء “أ” والدواء “ب”. سنأخذ مجموعة من البالغين الأصحاء الطبيعيين ونضعهم في ظروف موحدة – عادةً ما يصومون طوال الليل ثم نعطيهم الدواء على معدة فارغة أو مع وجبة موحدة. سنعطي الدواء أ للمريض، ونأخذ عينات دم متسلسلة، ثم نحسب معدل الامتصاص والمدى الإجمالي للامتصاص Cmax/tmax وAUC. لاحقًا، بعد أن يتم التخلص من الدواء بالكامل من الجسم، سنكرر العملية على نفس المريض، وفي نفس الظروف، مع الدواء B. ويمكن إجراء ذلك على أكثر من 20 مريضًا. سنحصل على رسم بياني يبدو كالتالي:
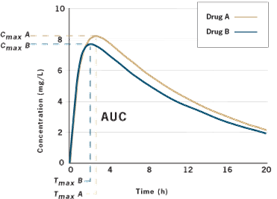
رسم بياني نموذجي للتركيز والزمن لمنتجين دوائيين
هل المنحنيان متماثلان ؟
ليس تماماً، في هذا المثال. هناك اختلافات طفيفة في مدى الامتصاص. هل هذين العقارين مكافئان حيوياً؟
هنا يأتي دور الإحصائيات. نحن نطبق الإحصائيات لتقييم ما إذا كانت المنحنيات مختلفة بشكل ملموس. للقيام بذلك، نحتاج إلى وضع بعض الافتراضات حول ما سنقبله كاختلاف ذي معنى. هل الاختلاف الطفيف في معدل أو مدى الامتصاص يحدث فرقًا سريريًا؟
قد قررت معظم الهيئات التنظيمية في جميع أنحاء العالم IPRP أن الاختلاف بنسبة 20% ليس مهمًا من الناحية السريرية بشكل عام.
يُقال بشكل عام أن نسختين من الدواء مكافئان حيويًا إذا كانت مجالات الثقة confidence intervals (وهي نسبة قياسية) تساوي 90% لنسب المتوسطات الهندسية (العلامة التجارية مقابل النوعية أو المثيل) للمساحة تحت المنحنى ومعدل الامتصاص الاجمالي تقع ضمن 80% و125%. يجب أيضًا أن يكون الوقت الاجمالي للامتصاص (العلامة التجارية مقابل النوع العام) قابلين للمقارنة — ويجب ألا يكون هناك أي اختلافات كبيرة بين المرضى.
ولأغراض عملية، تحتوي الإصدارات العامة من الأدوية ذات العلامات التجارية على نسب معدل الامتصاص والمعدل الاجمالي للامتصاص قريبة جدًا من الواحد. ومع وجود تباين كبير في أي من القيمتين، فمن غير المرجح أن يقع مجال الثقة ضمن نطاق 80% إلى 125%.
الخرافات والمفاهيم الخاطئة
يتم تصنيع الأدوية الجنيسة (المثيل) بشكل مختلف عن الأدوية ذات العلامات التجارية، ويستخدم مصنعو الأدوية ذات العلامات التجارية عمليات وجودة أفضل.
إذا كان شكل الجرعة يطلق نفس الدواء بنفس علاقة التركيز/الوقت، فإن أي اختلافات طفيفة في التصنيع لا علاقة لها بالنشاط الدوائي. لقد أنشأ المنظمون ممارسات ومعايير تصنيع موحدة، تسمى ممارسات التصنيع الجيدة (GMP)، والتي يتعين على جميع الشركات المصنعة، سواء كانت ذات علامات تجارية أو عامة، الالتزام بها. ويجب أن تستوفي المنتجات النهائية نفس معايير جودة المنتج أيضًا.
تعد دراسات التكافؤ الحيوي ضرورية دائمًا لإثبات قابلية التبادل.
بالنسبة لبعض أشكال الجرعات، قد تكون دراسات التكافؤ الحيوي غير مناسبة أو غير عملية. مثل قطرات العين التي قد يكون من الأنسب التحقق من التكافؤ من خلال مقارنة الخواص الفيزيائية والكيميائية بما في ذلك الرقم الهيدروجيني واللزوجة و الأسمولية والأسموزية. عندما يتم تقييم جميع المعملات ذات الصلة لتكون قابلة للمقارنة، فإن الهيئات التنظيمية ستعتبرالأدوية الأصيلة قابلة للتبديل بناءً على هذه المعاملات وحدها.
يجب اختبار الأدوية الجنيسة على المرضى، وليس على المتطوعين الأصحاء.
الهدف من مقارنة التكافؤ الحيوي هو تحديد الاختلافات في التركيبة بين منتجين دوائيين. ويتم استخدام متطوعين أصحاء في دراسات التكافؤ الحيوي للتحكم وتجنب اختلافات المرضى، مما يعني أن أي اختلافات في التوافر البيولوجي ستكون نتيجة لمشاكل في صياغة الدواء، وليس مشاكل في المرضى. من أجل عزل تأثيرات تركيب الدواء، من الضروري إبقاء كل شيء آخر ثابتًا قدر الإمكان. إذا كانت التركيبات متسقة، فلن يختلف معدل ومدى امتصاص الدواء، وبالتالي يجب ألا يكون هناك اختلافات في التأثيرات الدوائية للأدوية.
لا أستطيع مطلقًا أخذ نسخة عامة من وصفتي الطبية.
عادة لا يكون مصنعو الأدوية الحاصلون على براءات اختراع على استعداد للتضحية بكامل حصتهم في السوق لصالح المنافسين. سيبدأ البعض في إنتاج إصدارات “عامة” من أدويتهم الخاصة، وبيعها إلى شريك أو شركة فرعية ستبيعها على أنها “أدوية فائقة الجودة”. لذلك، في كثير من الحالات، سيكون واحد على الأقل من الإصدارات العامة التي يتم تسويقها متطابقًا تمامًا باستثناء العلامات التجارية.
لدي رد فعل سلبي أو تأثير جانبي جديد تجاه الدواء العام.
لا توجد متطلبات لأن تحتوي الأدوية المثيلة على نفس المكونات غير الفعالة التي يحتوي عليها الدواء ذو العلامة التجارية المواد الخاملة excipients)) بشكل عام، لكن هناك اقتراحات بأن الحساسية الخطيرة قد نادرًا ما تؤثر على بعض المرضى. ومع ذلك، فإن الشكاوى حول عدم التحمل في غياب استجابة حساسية حقيقية أو حساسية موثقة يمكن أن تكون أعراض سلبية تثيرها التوقعات السلبية المسبقة من المريض.
اختبار التكافؤ الحيوي ليس طريقة تقييم مقبولة
ليست الشركات العامة فقط هي التي يجب أن تقوم بدراسات التكافؤ الحيوي. وقد تحتاج الشركة المالكة لبراءة الاختراع إلى إجراء نفس الدراسات. أي تغييرات في شكل الجرعة سواء أثناء التطوير، أو بعد تسويق المنتج، قد تتطلب إجراء دراسات التكافؤ الحيوي لإثبات أن التغييرات لا تغير بشكل ملموس منحنى التركيز-الزمن. لذا، إذا كانت التجربة السريرية عبارة عن كبسولة، وكان المنتج النهائي المسوق عبارة عن أقراص، فقد يكون من الضروري إجراء دراسة التكافؤ الحيوي، وهذا يطمئن المنظمين بأن التجارب السريرية لا تزال ذات صلة وقابلة للتطبيق على شكل الجرعة الجديد.
نهايةً فإن الدراسات التي قيمت التأثيرات السريرية للبدائل العامة تقول بأن أدوية مثل التي تستخدم للقلب والأوعية الدموية لم تجد دليل على أن الأدوية ذات الأسماء التجارية كانت متفوقة فيما يتعلق بالنتائج السريرية.
- لم تجد التجارب والشواهد التي تقارن المضادات الحيوية ذات العلامة التجارية مقابل المضادات الحيوية العامة أي اختلافات في التأثيرات السريرية.
- أجرت إدارة الغذاء والدواء FDA تقييمها الخاص لمثبطات حمض المعدة (مثل Prilosec/Losec). استوفت جميع الأدوية العامة الخمسة معايير الذوبان.
- الليفوثيروكسين كمادة فعالة غير مستقر، وقد قامت إدارة الغذاء والدواء مؤخرًا بتشديد معايير التصنيع لجميع الإصدارات. ولا توجد حالات موثقة جيدًا لعدم التكافؤ العلاجي بين العلامات التجارية التي تعتبر متكافئة بيولوجيًا. ومع ذلك، لا يزال معظم المتخصصين في مجال الصحة يوصون باستخدام دواء العلامة تجارية.
- بالنسبة لأدوية الصرع فقد أسفرت دراسات الحالات والشواهد بعدم وجود التكافؤ العلاجي بين الدواء الأصيل والمثيل. ونظرًا لحدود هذه الدراسات (قد يختلف المرضى الذين قاموا بتبديل العلامات التجارية بطريقة ما عن أولئك الذين لم يغيروا العلامات التجارية)، ورغم أن البيانات ليست قاطعة من الناحية السريرية لكن يتوخى معظم المهنيين الصحيين الحذر عند التحول إلى الأدوية المضادة للصرع عامة.
وفي الختام
لقد تم تطبيق علم تقييمات التكافؤ الحيوي للأدوية الجنيسة في معظم البلدان لأكثر من 30 عامًا مع استخدام أساليب تقييم صارمة للغاية في وضع معايير للأدوية الجنيسة، حتى أنها أصبحت متوافقة إلى حد كبير بين جميع الجهات التنظيمية الرئيسية للأدوية في جميع أنحاء العالم. ويمكن طمأنة المستهلكين والمهنيين الصحيين على حد سواء بأن الأدوية الجنيسة أو المثيلة (المعتمدة بموجب هذه المعايير) هي في الواقع متكافئة بيولوجيًا، وبالتالي قابلة للتبديل مع المنتجات ذات العلامات التجارية.
المقال الأصلي:
Scott Gavura, Generic Drugs: Are they different? Science-based medicine, May 23, 2024
إعداد :
عمرو ياسر الرحماني
Amr Yasser Elrahmany
amryasser98@gmail.com

